Comme nous l'avons vu précédemment, l'araignée produit plusieurs types de fil. D'un point de vu physique, c'est le fil de traine, aussi appelé fil de sécurité, qui possède les caractéristiques les plus intéressantes, c'est pourquoi c'est de celui-ci dont nous allons étudier la composition chimique. Le fil de soie est constitué par un entrelacement d'un nombre élevé de fibrilles élémentaires, de 0.05 µm de diamètre chacun.
Ce fil de traine se compose d'un noyau de protéines filamenteuses, les fibroïnes (63,5%) et d'un enduit ressemblant à de la glue, composé d'une famille de protéines : les séricines (22,5%). Les 14 % restant représentent les traces de matières grasses, de minéraux et d'eau.
La fibroïne est principalement composée de glycine, d'alanine et de serine.
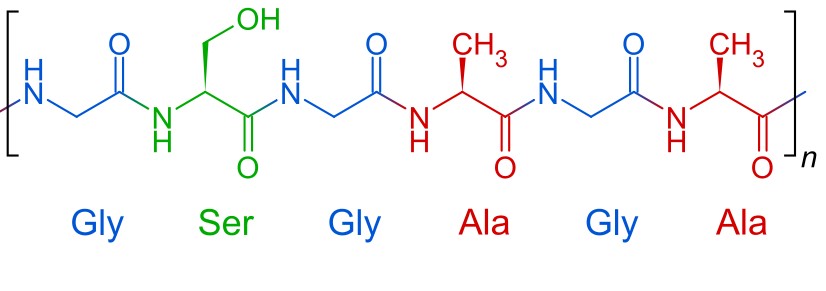
La séricine quant à elle est principalement constituée de sérine, d'acide aspartique et de glycine.
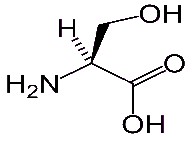
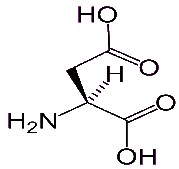
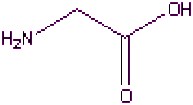
Sérine (C3H7NO3) Acide aspartique (C4H7NO4) Glycine (C2H5NO2)
Les groupes OH et O sont utiles pour faire les liaisons hydrogènes.

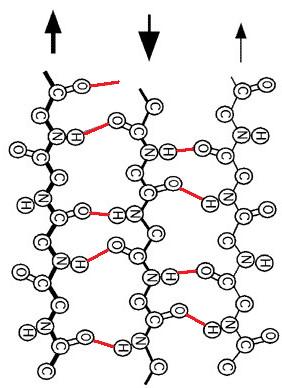
Cette image représente une fibrille d'un fil et non pas un fil de soie.
©httpwww.hiroshima-u.ac.jpindex.html
La fibroïne constitue la partie centrale du brin tandis que la séricine entoure la partie centrale du brin. Elle donne au fil sa coloration, mais c'est la fibroïne qui est à l'origine des propriétés mécaniques.
Ces propriétés mécaniques sont dues à l'agencement particulier que prennent les molécules au moment du tissage.
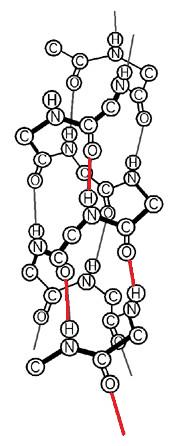
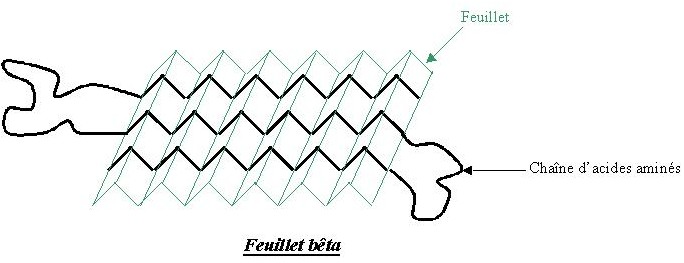
En effet, la fibroïne est formée d'un empilement de feuillets β antiparallèles, c'est à dire que pour une partie de la chaîne polypeptidique les acides aminés sont dans un ordre particulier, et pour l'autre ils sont dans le sens inverse. Elles est également composée d'hélices α qui ont cette forme particulière enroulée car leur chaîne a fait 2 ou un multiple de deux tours sur elle même.
feuillet bêta antiparallèle hélice alpha
Les feuillets β antiparallèles sont des zones riche en alanine. L'empilement des feuillets est d'une grande résistance grâce aux nombreuses liaisons hydrogènes. Mais ces liaisons sont "faibles" ce qui confère aussi de la flexibilité, car les liaisons ne sont pas très difficiles à rompre.
Les hélices α sont, quant à elles des séquences riches en glycine. Elles peuvent être comparées à des ressorts car la molécule peut se délier. C'est donc aussi un facteur de la flexibilité du fil de traine.

©http://www.ac-orleans-tours.fr
Ci dessous nous pouvons remarquer dans l'image de droite qui représente le fil à l'échelle moléculaire, des feuillets β au centre, des hélices α autour, et un désordre de boucles qui sont des structures non ordonnées.
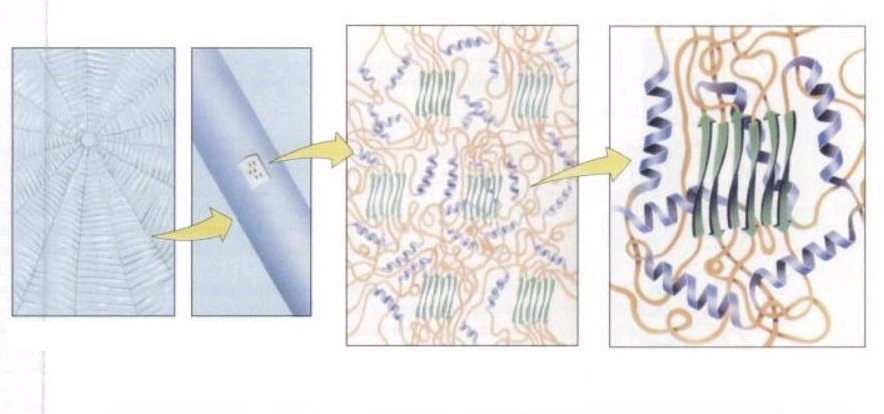
©Biochimie.Par Reginald H. Garrett,Charles M. Grisham,B. Lubochinsky. p.175


